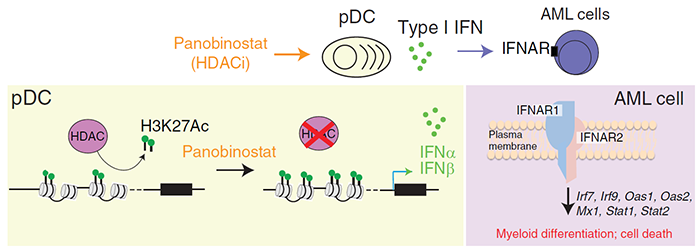
近日,澳大利亚彼得·麦卡伦癌症中心Ricky W. Johnstone和Pilar M. Dominguez团队,在Cancer Discovery期刊上发表题为Epigenetic activation of plasmacytoid DC drives IFNAR-dependent therapeutic differentiation of AML 的研究论文,表明组蛋白脱乙酰酶(HDAC)抑制剂panobinostat通过增加组蛋白乙酰化,诱导浆细胞样树突状细胞(pDC)增加I型干扰素(IFN)的表达,促进了白血病细胞分化,取得了显著的治疗效果。这是第一项研究表明了HDAC抑制剂可以通过对pDCs的免疫调节作用介导抗肿瘤反应,确定了表观遗传因子对肿瘤靶细胞和宿主免疫细胞的影响之间的独特分子相互作用。研究团队首先通过t(8;21) AML临床前小鼠模型研究了组蛋白脱乙酰酶(HDAC)小分子抑制剂帕比司他(Panobinostat)的治疗效果及作用机制,发现Panobinostat显著降低了模型小鼠肿瘤负荷以及延长38.5天的中位生存期。在Panobinostat治疗第五天后,小鼠体内白血病细胞只有10%处于S期,远小于对照组的40%,此外,细胞中CD11b表达增加,表明Panobinostat诱导白血病细胞周期停滞和终末分化。为了确定Panobinostat发挥抗白血病作用的转录变化,团队对小鼠体内的白血病细胞进行RNA测序,确定了Panobinostat治疗的时间点AML细胞表现出分化特征。通过基因集富集分析(GSEA)和基因本体论(GO)富集对差异的上调基因的通路分析揭示了与I型IFN通路相关基因的显著富集以及主要参与I型IFN 信号传导的转录因子(Stat1、Stat2、Irf1和Irf9)的普遍上调。敲除白血病细胞上的IFNAR1,可抵消Panobinostat的治疗效果。这些结果表明Panobinostat通过激活I型干扰素通路诱导AML细胞分化。鉴于暴露于Panobinostat的白血病细胞表现出I型IFN转录反应,团队进一步研究发现在Panobinostat处理的小鼠血清中没有检测到IFNα或IFNβ,说明Panobinostat诱导的I型IFN反应发生在局部而非全身组织中。浆细胞样DC(pDC),能产生大量I型IFN和其他细胞因子以响应病原体。流式细胞术证实了荷瘤小鼠中pDC的显着增加,Panobinostat治疗显着诱导了白血病小鼠pDC中 Ifna4和Ifnb1基因的转录。使用抗体封闭pDC,发现可以抵消Panobinostat治疗效果,说明了Panobinostat介导的pDC产生的I型IFN对于Panobinostat抗白血病作用非常重要。虽然团队专注于pDC的作用研究,但是也承认其它的免疫细胞可能也很重要,因为Panobinostat治疗的患有白血病的免疫缺陷小鼠(NSG;中位生存期 = 28天)不如免疫功能正常的小鼠(C57BL/6,中位生存期= 52天)。团队为了确定pDCs和常规树突细胞(cDCs)暴露于panobinostat是否导致控制IFN基因表达的调节区域的乙酰化增加,进行了染色质免疫沉淀和测序(ChIP-seq)研究,以探测H3K27乙酰化(H3K27Ac)。与对照组相比,从panobinostat治疗的白血病小鼠收获的pDCs中观察到H3K27Ac水平的全基因组增加,而从相同微环境中收获的常规DC细胞中H3K27Ac略有下降。说明了Panobinostat通过增加组蛋白乙酰化诱导pDC中I型IFN基因的转录激活。最后,结合Panobinostat和重组I型IFN可增强骨髓分化并提高小鼠和人类AML的治疗功效,突出了将HDACi和I型IFN结合作为治疗AML的新方法的治疗潜力。图1 panobinostat在pDC中诱导I型IFN表达机制的示意图,从而导致AML细胞中IFNAR的激活,诱导细胞分化和随后的细胞死亡总之,研究团队通过抑制组蛋白脱乙酰酶(HDAC)发现了一种新的免疫调节机制。HDAC抑制剂panobinostat通过IFN基因的转录激活伴随这些基因座处H3K27乙酰化增加,促进浆细胞样树突状细胞(pDC)产生I型IFN,介导了白血病细胞分化。这些发现为AML提供了一种新的治疗方法,并证明pDC的表观遗传激活可增强抗肿瘤免疫,从而为利用这种方法进行免疫治疗提供了可能性。https://doi.org/10.1158/2159-8290.CD-20-1145